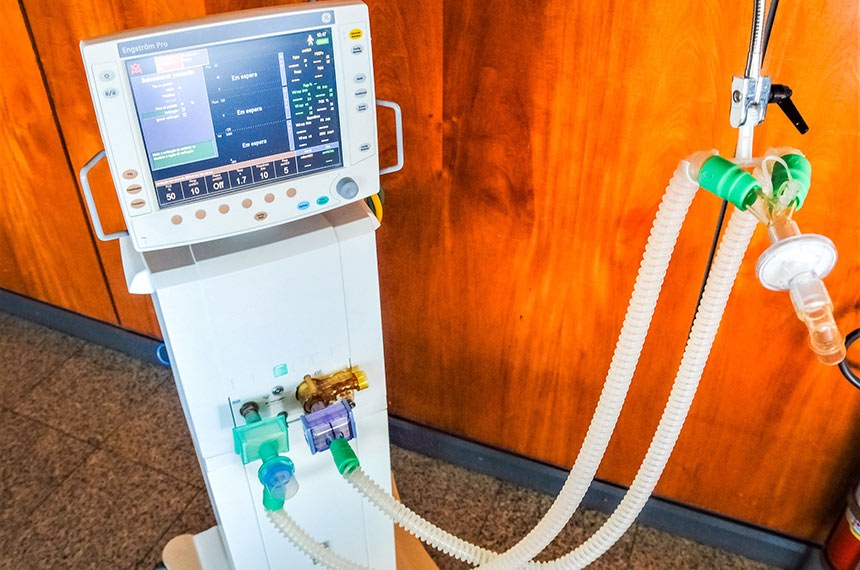
O Senado deve analisar um projeto para desburocratizar o processo de certificação de ventiladores pulmonares artificiais. O objetivo do PL 2.294-A/2020 é impulsionar a fabricação desses equipamentos pela indústria nacional para suprir a demanda decorrente da pandemia de covid-19. O equipamento fornece ventilação pulmonar artificial, provendo suporte a pacientes com insuficiência respiratória. O texto aprovado na Câmara, na quinta-feira (21), é um substitutivo do deputado Lafayette de Andrada (Republicanos-MG) à proposta original apresentada pelo deputado Carlos Chiodini (MDB-SC).
O projeto permite à Agência Nacional de Vigilância Sanitária (Anvisa) autorizar a fabricação e comercialização de ventiladores pulmonares com base em laudos de médicos especializados e projetos técnicos com padrões mundiais mínimos de qualidade. O texto disciplina ainda a homologação de equipamentos de suporte respiratório emergencial (Ambu) automatizados.
Pela proposta, a Anvisa terá 72 horas para certificar os aparelhos. Se houver irregularidades sanáveis, o interessado terá igual tempo para corrigi-las e o órgão sanitário, mais 72 horas para reanalisar a documentação.
A comercialização será autorizada por 180 dias e, caso haja comprovação de falsidade nas informações ou de que os aparelhos apresentam risco, a agência cancelará o registro.
O texto também fixa um prazo de 15 dias para análise do pedido de registro sanitário de produtos e insumos usados no diagnóstico in vitro da Covid-19, desde que obedecidos os requisitos impostos pela Anvisa para sua fabricação.
A empresa interessada em obter a certificação facilitada deverá entrar com pedido de registro simplificado na Anvisa. O projeto considera registro simplificado o cadastro de habilitação realizado por meio eletrônico no site do órgão.
Após entrar com o pedido, a empresa terá 180 dias para providenciar a Autorização de Funcionamento de Empresa (AFE), a licença sanitária e a certificação de boas práticas de fabricação para produtos de classe III.
Se quiser tornar o registro permanente, a empresa deverá seguir os procedimentos normais de certificação, de acordo com os regulamentos e a legislação ordinária em vigor.
Agilidade
O texto cria um regime extraordinário e temporário durante o estado de calamidade pública para agilizar os procedimentos exigidos pela Anvisa, mais detalhados e que demandam mais tempo de análise.
De qualquer forma, o órgão verificará se os aparelhos submetidos à certificação atendem os padrões mínimos de qualidade previstos em normas técnicas da Organização Mundial da Saúde (OMS) ou da agência reguladora de medicamentos e produtos para saúde da União Europeia (MHRA na sigla em inglês).
Quanto ao ventilador pulmonar, os padrões mínimos dependerão ainda de referendo da Associação de Medicina Intensiva Brasileira (Amib). O texto já especifica alguns parâmetros, como os relacionados ao controle de pressão da respiração forçada e da quantidade de oxigênio, ao controle do tempo de inspiração e da frequência respiratória.
Tanto para o ventilador pulmonar quanto para o aparelho de suporte respiratório, o substitutivo prevê a apresentação pelas empresas interessadas de documentação atestando o correto funcionamento do equipamento.
A documentação é composta por laudo emitido por laboratório credenciado atestando o atendimento de requisitos em testes eletromagnéticos e de segurança; teste pré-clínico, emitido por entidade competente, atestando que o produto se comportou conforme o esperado; e dois relatórios médicos emitidos por médicos intensivistas, vinculados a diferentes entidades hospitalares que utilizem esses tipos de equipamento, avaliando a eficiência, a aplicabilidade e a usabilidade do produto. O hospital não precisará ser qualificado como instituto de pesquisa.
Além disso, a empresa terá de apresentar termos de responsabilidade técnica e de responsabilidade do representante legal do fabricante de que a fabricação seguirá integralmente os parâmetros do protótipo aprovado.
Equipamento experimental
Os dois tipos de equipamentos tratados pelo projeto serão enquadrados como experimentais, e esse termo deve constar da etiqueta de identificação.
O substitutivo especifica que esses equipamentos devem ser fornecidos para pacientes com Covid-19 e com outras condições clínicas que recebam indicação médica para seu uso.
As entidades devem receber instruções específicas e treinamento para utilização, e as empresas devem fornecer garantia e serviços de pós-venda.
No caso dos ventiladores pulmonares, o uso deve contar com autorização prévia do hospital e do paciente. A reserva técnica (para substituição imediata em caso de defeitos) deverá ser de 5% no local de uso.
Em relação aos equipamentos de suporte respiratório, o texto exige autorização prévia apenas do hospital. Sobre o pós-venda, o fabricante terá de dar suporte de manutenção e manter, em fábrica, peças avulsas para troca pelo período mínimo de dois anos a contar da data de fornecimento.
Isenção
O substitutivo de Andrada concede ainda isenção de tributos federais, inclusive para a compra de insumos utilizados na fabricação, venda e fornecimento desses aparelhos. A isenção se estende aos tributos para importação e vendas no mercado interno dos ventiladores e dos equipamentos de suporte respiratório.
Outra isenção é quanto à taxa de vigilância sanitária. Todas as isenções se aplicam aos fatos geradores ocorridos durante o período da calamidade pública, que vai até 31 de dezembro deste ano.
Com Agência Câmara
Fonte: Agência Senado

Comentários